-
jinnian金年会官网
- ACD/Labs
- Certara
- Labware / Sparta Systems
- Materials Design
- OmniComm System
- OPENTEXT
- QIAGEN
- UL
-
jinnianhui金年会官网
- 热线:021-32504385
- 微博:jinnian金年会官方网站入口
- 邮件:hzdongrun

2024-03-10 00:28:29 来源:jinnianhui金年会官网 作者:jinnian金年会官网
实施电子实验记录系统(ELN)的主要挑战之一是从众多与实验数据交互的涉众者中获得支持,而这个挑战在GMP制造等验证环境中尤为显着。在GMP生产领域,需要遵守关于方法、流程、测试如何记录和验证的严格法规要求,这就导致更严格的内部控制,这些控制被编写入不易改变的基于纸质记录的工作流程中。阿斯利康GMP环境中API生产的已经得到验证,想在这个环境下应用电子实验记录系统,并且还要提高工作流效率,这就给电子实验记录系统的实施和应用带来巨大挑战。
1、现状和挑战·科学家、工艺工程师、质量控制和保证人员习惯于纸质记录,并认为纸质记录及其相关的工作流程是标准的、熟悉的、能够满足记录需求,需要获得内部人员对电子实验记录系统的认可。·二十世纪初,大多数ELN主要部署在发现化学领域,因此需要选择一个具有扩展潜力的ELN产品和供应商,具备开发和扩展能力的系统才能够帮助阿斯利康消除研发与GMP生产的鸿沟,以便能在验证环境中成功地管理数据。·阿斯利康的用户只希望系统运行速度够快,因此需要向大家展示采用ELN会给大家带来意想不到的好处。
·允许将过程信息通过研发的所有阶段无缝转移到商业制造。期望ELN将消除不同文档类型之间的转录:从过程化学ELN记录到模板化的基于Word的过程描述配方和工艺;从打印的过程描述到早期生产活动中基于纸质的批记录;以及返回模板化的Word文档批记录和活动报告。·提高阿斯利康GMP环境中API生产的已验证的工作流效率。
·BIOVIA Workbook (之前的Accelrys Electronic Lab Notebook,最初的Symyx Notebook),2004年采用了早期版本的Symyx Notebook。采取迭代的实施方案,从定义问题开始,收集需求并创建一个概念进行原型试用,并继续通过收集反馈,修·改和运行以改进原型试用。逐渐摆脱基于纸质记录管理文档的习惯,并真正开始改进所期望支持的实际业务流程。
阿斯利康重新考虑了从纸质记录过渡到电子记录的技术转移的各个方面。如图所示,描绘了阿斯利康从合成化学研发到生产转移过程的整体工作流程。当电子批记录项目开始时,管理者提出或可使用单一的“生产方法”文件来描述所有生产要求。但是阿斯利康药物开发团队意识到这一建议是基于纸记录的思想,实际上会造成工作流程瓶颈。
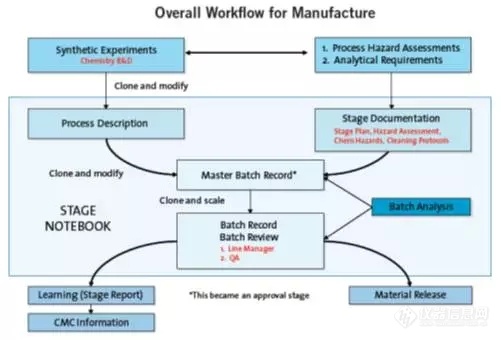
在电子世界里,你不需要一个文件”,阿斯利康药物发展团队首席科学家Leonard说,“创建并用于描述过程的所有记录可以一起收集在一个文件夹中,可以轻松找到并引用它们。这是突破性的,实现了ELN的价值——作为管理和分发记录的核心,使其成为我们的GMP系统的关键要素,使我们的工作流程更加合乎逻辑和高效。”
阿斯利康工作流程的核心是支持一个简单的文件夹结构,其中包含所有的生产相关的文档,包括非ELN(Word、Excel等)文件。每个生产活动都有一个单独的文件夹,其中包含每个活动阶段的单独的阶段记录本。因此,阿斯利康的整体生产工作流程需要将实验和分析数据转移到工艺化学。阿斯利康公司并不是试图开发一个单一的文档来包含所有这些信息,而是使用“单独文件夹 – 阶段记录本”的方式将所有相关文档保存在一起。
“解决方案:阶段记录本是一个存储库,包含工艺描述、主批记录、个批记录”1、 工艺描述:这是由工艺研发化学家在阶段记录本上创建的,通常来自实验室进行的实验程序的克隆。 工艺描述被开发生产化学家改进,并包含评论、观察项和保留点。电子审批工作流支持生产线、主批记录:这最初是通过克隆过程描述准备的。在重要的处理步骤和每个重要的单位操作结束时,都会添加在生产过程中提供审计追踪点的登记点。 最终的主批记录再次被电子签名批准,以在审计追踪记录中创建永久的预生产版本。3、个别批记录:这些文档是从主批记录中克隆产生。物料数量按比例缩放到所需的批量大小,并由ELN系统自动填充,与手动方法相比,确保了精度,且节省了大量的时间。工序环节在批量生产时被简单地注释,并且根据需要更新实际数量偏差和次要过程偏移。一旦批生产完成,最终评论和学习点将添加到文档中,最终被登记,并由生产线和质量保证经理检查和批准。实施成果:1、ELN提供了经过验证的完全合规化的环境,包含用于存储所有生产文档的强大的、定时的审核跟踪。2、阿斯利康还制定开发了程序来控制验证环境以外的文件的使用。在所有文档工作流程结束时,在集中且易于访问的位置发布提供永久的可见版本的文档。试点证明带来的价值:1、阿斯利康公司开展了广泛的试点来评估和确认ELN的功能,验证其工作流程和程序控制的有效性,并确定要完善的领域。2、一年来进行的大量GMP试验提供了指标,表明电子批记录系统比以前的纸质系统更能提升效率。文档方面节省时间超过50%-产生的文档减少,主要是因为使用阶段记录本实际上减少了生产文档产生的数量。而且相对于纸质记录的方式,电子记录文档的整体质量得到大大提高。3、阿斯利康公司的研发和运营质量保证小组也进行了合规和质量审核:独立审计的结论是,该系统“在合规性方面总体上可以接受”。研发质量保证小组对文档的透明度感到特别高兴,这使得质量保证评估易于进行,并可使工艺化学更多地了解生产工艺。4、消除GMP环境中API生产基于纸质的工作流程。5、优化的流程提高了整体质量保证和法规符合性。持续发展:阿斯利康公司就如何处理以前的数据完整性做法进行了广泛的修改,使得现有的内部原始数据记录指导与现代的外部风险评估指导一致。该修订确保有意识地决定是否对与要求的审计跟踪事件相关联的记录进行修订或更改。试点还揭示了以前版本的ELN如何防止批记录更新期间已有数据的变化方面的一些不足。阿斯利康通过实施明确的程序和指导来处理这个问题。此外,公司制定了一项系统改进计划,以确保未来版本的ELN能够在批记录中对文本型数据模块进行“锁定”。“供应商完全愿意一起合作以帮助解决我们的担忧”,Leonard说,“我们计划与其他制药公司分享我们的结论,以便建立这一领域的跨行业标准。”阿斯利康的质量保证小组在试点过程中提出的一些问题有助于推动更有效率的工作实践,以及更好的质量程序,这些程序可以在生产现场进行协调。通过消除非价值追加程序可以获得更多的效益,通过澄清诸如过程中测试和控制等方面的目的和要求来提高质量管理。“质量保证功能确认了一个机会,去建立一个定义的GMP生产临床试验API的业务流程,作为药物质量体系(PQS)的一部分,所有这些都符合ICH(人用药物注册技术要求国际协调会)建立的现代监管指南”,Leonard说。
阿斯利康和BIOVIA合作=成功Leonard坚持认为,如果没有组织的同事和合作伙伴的投入,他们的ELN实施将不会成功。例如,在阿斯利康假设电子批记录项目主要旨在提高研发与开发生产之间信息传递的技术效率,这可能会使项目脱轨,因为内部合规完全是为了促进纸质质量控制体系而设计的。 “通过改进质量管理作为中心目标来改革‘整体’项目,使我们能够与质量保证和合规代表建立积极的合作关系”,Leonard说,“我们共同认识到,采用结构化的方法来记录生产过程,可以轻松创建全球业务流程,质量保证功能可以作为协调各个站点和支持药物质量体系(PQS)的机会。”
他总结说:“我现在的建议是,通过PQS、业务流程方法启动电子批次记录项目,这是获取所有关键利益相关者支持,并认识到这项工作的普遍价值的最佳途径。”阿斯利康医药发展首席科学家John Leonard 原话引用:“将ELN的价值看作管理和分发记录的核心,并将其作为我们的GMP系统的关键要素,使我们的工作流程更加合乎逻辑和高效。”

Accelrys公司是一家专业的化学信息处理技术提供商,多年来致力于实验记录的电子化管理,尤其重视实验过程中化学信息解决方案的研发。开发出了具有化学信息处理、实验数据管理和实验数据集成能力的电子实验记录系统原名Accelrys ELN。Accelrys公司被Dassault Systems收购后,公司更名为Dassault Systems Biovia, 相应地Accelrys ELN更名为Biovia Workbook。这个产品综合了纸质记录本的灵活性和电子系统强大的数据管理能力,具有较强的企业级应用功能,已在化工、生物、分析、工艺等不同领域得到广泛应用。
创腾科技是全球最大的电子实验记录和分子模拟产品供应商Dassault Systemes Biovia公司(原Accelrys公司)、全球最大的实验信息管理系统(LIMS)供应商ThermoFisher公司在中国的战略合作伙伴。因此,创腾科技能够为中国的科研机构、生产企业和检测实验室提供当前世界上最先进的电子实验记录系统、信息与流程管理平台、分子模拟软件以及实验室信息管理系统。创腾科技有限公司目前拥有超过60人的咨询、实施、验证和开发队伍,是国内实施基于GCP/GLP/GMP/17025规范的信息系统最多的企业。所有实施、验证团队成员均来自于国内外著名医药公司和实验室,并熟悉生物分析业务以及流程,有丰富的LIMS产品实施和验证经验,曾经有多家CRO公司、科研机构、学术单位、医院/I期临床实验室、制药公司成功上线的案例,具有足够的能力协助生物分析实验室实现实验室信息化发展。· 相关云端的电子实验记录本软件查询,请点击此处
